
Reportáže a rozhovory z odborných kongresů
Přestože byla terapie mnohočetného myelomu (MM) v posledním desetiletí zcela zásadně zdokonalena, nadále zůstává nevyléčitelným onemocněním. Zvláště tristní prognózu mají pacienti refrakterní vůči imunomodulačním látkám a inhibitorům proteazomu (PI). Vývoj cílené léčby za použití monoklonálních protilátek (mAb) dále posouvá vyhlídky nemocných a výsledkem je nebývalá míra odpovědí na léčbu i u nejvíce rizikových pacientů. Žhavou novinkou je v tomto smyslu elotuzumab, který byl nedávno schválen FDA. Na co se tedy mohou v dohledné budoucnosti těšit nemocní a jejich lékaři?
MM je závažným onemocněním především z důvodu výskytu nádorových specifických faktorů, jako jsou adverzní cytogenetická změna či inherentní rezistence na terapii. K překonání těchto komplexních bariér je třeba využít nových terapeutických strategií. Patří mezi ně například elotuzumab, monoklonální protilátka, kterou k léčbě MM nedávno schválil FDA (US Food and Drug Administration).
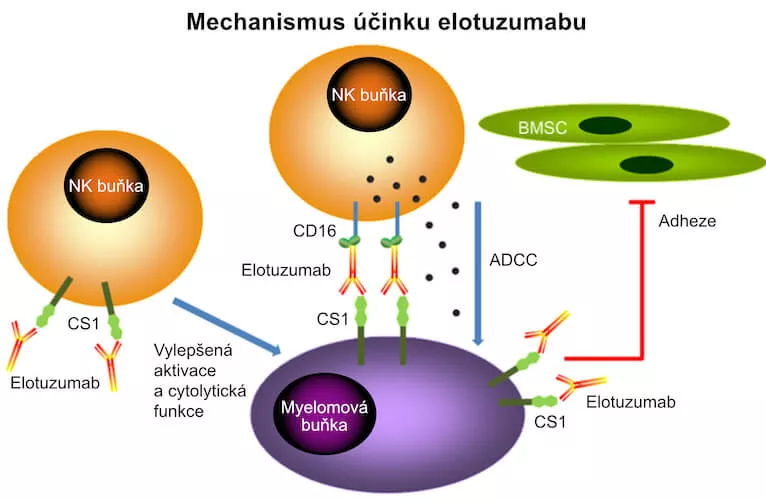
Tato humanizovaná, IgG1 monoklonální protilátka je specificky zaměřena na protein CS1 (též SLAMF7 – signaling lymphocyte activation molecule family member 7). Využitím profilace genové exprese demonstroval Hsi ED et al. (Clin Cancer Res 2008) vysokou expresi CS1 v plazmatických buňkách zdravého dobrovolníka, u pacientů s monoklonální gamapatií nejasného významu (MGUS) i u pacientů s potvrzeným MM. Exprese CS1 byla zachována u všech nemocných, a to bez ohledu na cytogenetiku nebo předchozí léčebné linie.
Nižší úrovně exprese CS1 pak způsobovali přirození zabíječi, T-buňky, CD8+ T-buňky, aktivované monocyty a dendritické buňky. V normální tkáni k expresi CS1 téměř nedocházelo (Hsi ED et al., Clin Cancer Res 2008; Tai YT et al., Blood 2008), čehož lze využít k vysoce cílené léčbě s minimem nežádoucích účinků.
Mechanismus účinku tohoto léčivého přípravku vychází z vazby na CS1, který pak přes Fc receptory aktivuje přirozené zabíječe. Jejich aktivace vede k uvolnění perforinových granulí, jež nakonec cíleně likvidují myelomové buňky prostřednictvím mechanismu buněčné cytotoxicity závislé na protilátkách (ADCC – antibody-dependent cellular cytotoxicity).
Ve studii fáze I byla ověřována monoterapie elotuzumabem s eskalací dávky u pacientů s relabujícím či refrakterním MM (RRMM) (Zonder JA et al., Blood 2012). Elotuzumab vykazoval jen mírnou aktivitu u 26 % pacientů ve stabilizovaném stavu a u 74 % nemocných s progresí. Lék byl zároveň dobře tolerován, nebylo dosaženo žádné maximální tolerované dávky ani při maximální plánované dávce 20 mg/kg.
Několik jiných studií fáze I kombinovalo elotuzumab s jinou, osvědčenou účinnou látkou, např. s bortezomibem (Jakubowiak AJ et al., J Clin Oncol 2012) nebo lenalidomidem (Lonial S et al., J Clin Oncol 2012). Bylo dosaženo působivých hodnot celkové odpovědi na léčbu (ORR – overall response rate – 48 %, resp. 82 %) a mediánu doby do progrese (TTP – time to progression – 9,4 měsíce, resp. nedosažená progrese po dobu 16,4 měsíce v rameni s dávkou 20 mg/kg). Mezi nejběžnější hlášené nežádoucí účinky patřila lymfopenie a únava.
Fáze II zahrnovala 72 pacientů s RRMM, kterým byl i.v. podán elotuzumab v dávce 10 nebo 20 mg/kg (den 1, 8, 15 a 22 z celkem 28 dnů v cyklech 1–2, a den 1 a 15 v cyklech ≥ 3) v kombinaci s lenalidomidem 25 mg (dny 1–21) spolu s nízkou dávkou dexametazonu (40 mg/týden) (Lonial S et al., J Clin Oncol 2012). Pacienti byli lenalidomid-naivní, kromě určité skupiny nemocných ze studie fáze I, u níž byla povolena předchozí expozice. Hodnoty celkové objektivní odpovědi na léčbu dosáhly 84 % (92 % s dávkou 10 mg/kg a 76 % s dávkou 20 mg/kg i.v.). Z nežádoucích účinků byly nejčastěji uváděny průjmy (66 %), svalové spasmy (62 %) a únava (56 %). Medián doby přežití bez progrese (PFS – progression-free survival) činil přibližně 30 měsíců v obou ramenech studie.
Otevřená, randomizovaná studie fáze II porovnávala účinky kombinace elotuzumab/bortezomib/dexametazon (EBd) s efektivitou kombinace bortezomib/dexametazon (Bd) u 152 pacientů s RRMM (Jakubowiak AJ et al., Blood 2016). Pacienti nemohli být refrakterní vůči PI (tj. zůstat bez progrese v průběhu léčby nebo během 60 dnů od poslední dávky). Ačkoliv bylo v rámci primární analýzy dosaženo 28% snížení rizika progrese či úmrtí u EBd vs. Bd, sekundární analýza neprokázala zásadní rozdíl (66 % EBd vs. 63 % Bd) v celkové četnosti odpovědí (ORR).
Multicentrická, randomizovaná, otevřená studie fáze III (ELOQUENT-2) zahrnovala 646 pacientů s RRMM, kterým byl podán elotuzumab s lenolidamidem a dexametazonem (ELd) nebo pouze lenalidomid s dexametazonem (Ld). Elotuzumab byl aplikován v dávce 10 mg/kg v den 1, 8, 15 a 22 v cyklech 1–2 a následně v den 1 a 15 v cyklech 3–18.
Po 2 letech činil PFS ve skupině ELd 41 % oproti 27 % ve skupině Ld. Medián PFS ve skupině ELd dosáhl 19,4 měsíce vs. 14,9 měsíce u skupiny Ld (p < 0,001). Dosažená ORR mezi skupinami ELd a Ld byla 79 %, resp. 66 % (p < 0,001). Závažné nežádoucí účinky se objevily v 65 % (ELd) a 57 % případů. Šlo o neutropenii stupně 3 a 4 (34 % skupina ELd, 44 % skupina Ld), lymfopenii stupně 3 a 4 (77 %, resp. 49 %). Výskyt infekcí byl v obou skupinách stejný kromě herpes zoster, jehož incidence byla vyšší u pacientů léčených ELd.
Použití elotuzumabu spolu s lenalidomidem a dexametazonem snížilo riziko progrese o 30 %, s následnou aktualizovanou analýzou doby přežití, která favorizuje ELd (Dimopoulos MA et al., Blood 2015). Na základě výsledků této studie schválil FDA použití elotuzumabu v kombinaci s lenalidomidem a dexametazonem v léčbě MM u pacientů, kteří již podstoupili 1–3 dřívější terapie.
(red)
Reklamní sdělení

Reportáže a rozhovory z odborných kongresů
Opouštíte prostředí společnosti Pfizer, spol. s r. o.
Společnost Pfizer, spol. s r. o., neručí za obsah stránek, které hodláte navštívit.
Přejete si pokračovat?