
Reportáže a rozhovory z odborných kongresů
Americký Úřad pro léky a potraviny (FDA) schválil teplizumab, vůbec první monoklonální protilátku v léčbě diabetu 1. typu. Je to největší průlom v léčbě tohoto onemocnění od objevení inzulinu před 100 lety, protože jde o přístup, který se snaží ovlivnit samotný proces vedoucí k destrukci tkáně pankreatu produkující inzulin. I když nová léčba přináší velká očekávání, mnoho otazníků s ní spojených zůstává zatím nezodpovězených.

Americká léková autorita FDA (Food and Drug Administration) schválila koncem listopadu 2022 anti-CD3 monoklonální protilátku teplizumab k léčbě, která oddaluje nástup klinických příznaků diabetu 1. typu (DM1) u dospělých a dětských pacientů starších 8 let, jež mají vysoké riziko rozvoje tohoto onemocnění. Látka, která interferuje s T-buňkami zprostředkovanou autoimunitní destrukcí pankreatických beta-buněk, je první terapií modifikující onemocnění, jež brání progresi DM1. Podává se ve formě intravenózní infuze jednou denně po dobu 14 po sobě jdoucích dnů.
Přelomové schválení teplizumabu v USA odborníci považují za začátek nového přístupu k léčbě DM1. Po 100 letech, kdy byli diabetici 1. typu při léčbě odkázáni pouze na inzulinoterapii, umožňuje schválení teplizumabu ovlivnit hlavní příčinu tohoto stavu – autoimunitní proces vedoucí k destrukci beta-buněk Langerhansových ostrůvků pankreatu. Lék, který FDA schválila, zatím nedokáže DM1 vyléčit, ale oddaluje rozvoj tohoto onemocnění v průměru o dva roky a u některých pacientů mnohem déle – nejdelší doba je zatím 11 let. „Potenciál teplizumabu oddálit klinickou diagnózu diabetu 1. typu může diabetikům poskytnout měsíce až roky bez zátěže způsobené touto nemocí,“ vyzdvihl přínos nové léčby John Sharretts, ředitel metabolické divize Centra pro hodnocení a výzkum léků FDA.
Bezpečnost a účinnost teplizumabu byla hodnocena v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii, které se účastnilo 76 osob s vysokým rizikem rozvoje diabetu 1. typu. Šlo o příbuzné diabetiků 1. typu, kteří ještě neměli klinicky vyjádřený diabetes, ale měli porušenou glukózovou toleranci nebo zvýšenou glykemii nalačno a potvrzenou přítomnost dvou či více autoprotilátek specifických pro DM1 (anti-GAD, anti-IA2, anti-IAA, anti-ZnT8). V 72 % šlo o děti mladší 18 let (medián věku byl 14 let) s mírnou převahou chlapců, přičemž více než v polovině to byli sourozenci diabetiků 1. typu. Zbytek souboru tvořili rodiče nebo potomci či další příbuzní osob s DM1.
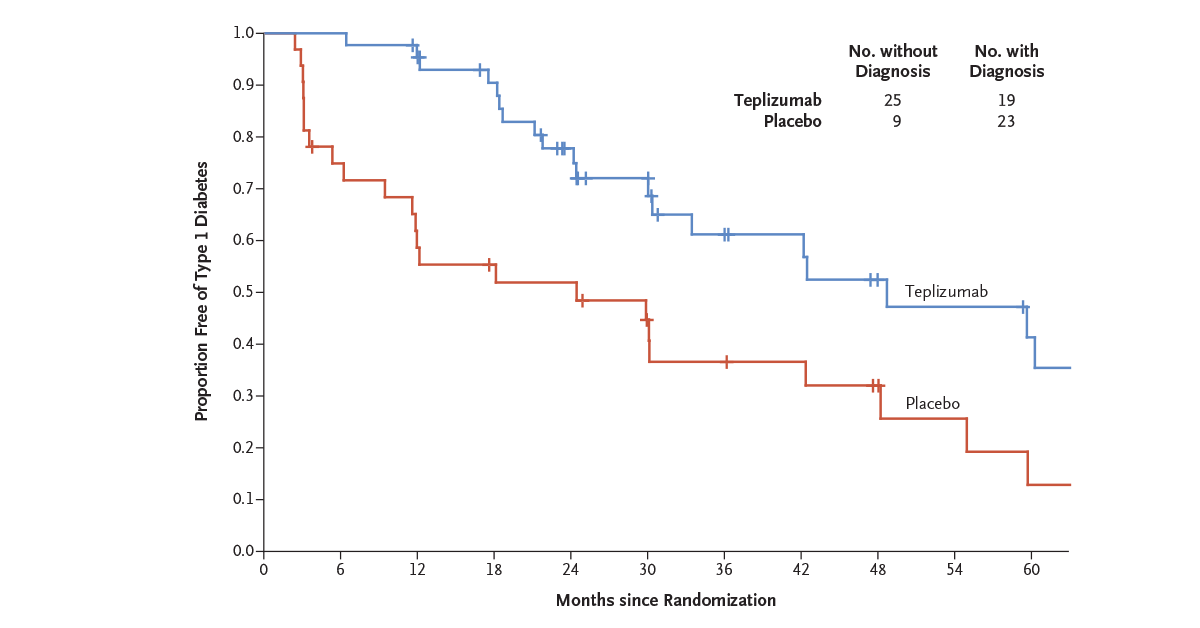
Účastníci studie byli náhodně randomizováni k podání teplizumabu (n = 44) nebo placeba (n = 32). Primárním cílem byla doba do rozvoje klinické diagnózy diabetu 1. typu. Výsledky studie ukázaly, že během střední doby sledování 745 dnů byl u 43 % pacientů, kteří dostávali teplizumab, diagnostikován diabetes 1. typu, ve srovnání se 72 % osob z placebové skupiny. Medián doby do stanovení diagnózy DM1 byl 48,4 měsíce ve skupině s teplizumabem a 24,4 měsíce v placebové skupině (HR = 0,41; p = 0,006). Mezi nejčastějšími nežádoucí účinky teplizumabu byla lymfopenie (73 % teplizumab vs. 6 % placebo), vyrážka (36 % vs. 0 %), leukopenie (21 % vs. 0 %) a bolest hlavy (11 % vs. 6 %).
V rámci následného prodlouženého sledování (medián 923 dnů) bylo zjištěno, že medián doby do diagnózy byl 59,6 měsíce u účastníků léčených teplizumabem a 27,1 měsíce u účastníků léčených placebem (HR = 0,457; p = 0,01), bez diabetu zůstalo 50 % pacientů léčených teplizumabem, ale pouze 22 % nemocných v placebové skupině. To představuje u lidí, kteří měli vysoké riziko rozvoje DM1, statisticky významné zpomalení progrese ztráty beta-buněk a oddálení klinicky manifestního onemocnění.
Dodejme, že diabetes 1. typu je typickým příkladem polygenního multifaktoriálního onemocnění. Předpokládá se, že k destrukci beta-buněk dochází autoimunitními mechanismy, které jsou spouštěny působením faktorů zevního prostředí u osob s určitým genetickým rizikem.
Nástup autoimunitního procesu vedoucího k manifestnímu DM1 je pozvolný. Lymfocyty, zejména CD8+ T-buňky, při něm infiltrují a pomalu ničí beta-buňky Langerhansových ostrůvků pankreatu. Rozlišujeme tři fáze diabetu 1. typu: Fáze 1 je charakterizována normálními glykemiemi, asymptomatickým průběhem a minimálně dvěma pozitivními autoprotilátkami specifickými pro DM1. Ve fázi 2 přetrvává pozitivita autoprotilátek, nicméně občas, ne trvale, se objevují klinicky nevýznamné hyperglykemie, které nevedou k symptomům diabetu. Fáze 3 je již symptomatická, s typickými projevy diabetu a jednoznačnými hyperglykemiemi diagnostickými pro DM1.
Rychlost rozvoje do fáze 3, tedy klinického DM1, závisí zejména na počtu detekovaných autoprotilátek a věku při sérokonverzi. V případě pozitivity pouze jedné autoprotilátky (a to platí zejména v případě anti-GAD) je 20leté riziko progrese přibližně 20 %, pokud detekujeme dvě a více protilátek, stoupá toto riziko nad 80 % v průběhu 5 let. Monoklonální protilátka teplizumab byla schválena pro preventivní léčbu u osob ve 2. fázi DM1.
Připomeňme, že prevalence DM1 celosvětově i u nás neustále narůstá. Odhaduje se, že tímto onemocněním trpí v České republice 5–6 % pacientů z celkového počtu více než milionu diabetiků, přičemž z dat Českého registru dětského diabetu (České národní dětské diabetické databáze) vyplývá, že incidence DM1 u nás za posledních 30 let stoupla ze 7 na 25 případů na 100 000 zdravých dětí.
Přestože byl inzulin objeven před 100 lety a technologie pro podávání a monitorování léčby touto látkou zlepšily kvalitu života pacientů a snížily komplikace diabetického onemocnění, zůstává diabetes stále nevyléčitelný, přičemž dlouhodobé vystavení organismu hyperglykemii vede u pacientů k rozvoji závažných mikrovaskulárních i makrovaskulárních komplikací.
Navzdory tomu, že preventivní imunoterapie teplizumabem vzbuzuje oprávněné nadšení pacientů, odborníci upozorňují, že může být účinná pouze v kombinaci se screeningovými programy k identifikaci rizikových osob, které z podání této léčby mohou profitovat. V současnosti jsou autoprotilátky specifické pro DM1 preventivně vyšetřovány zejména u prvostupňových příbuzných diabetiků 1. typu, avšak 85–90 % pacientů, u nichž se rozvine DM1, nemá prvostupňové příbuzné s tímto onemocněním, a proto by byl k identifikaci většího počtu vhodných kandidátů pro teplizumab potřeba širší populační screening.
Větší rozšíření takového screeningu i masovější využití preventivní imunoterapie DM1 bude však jistě narážet na finanční bariéry. Cena teplizumabu, který vyrábí pod firemním názvem Tzield americká společnost Provention Bio, byla v USA stanovena na téměř 14 000 dolarů za jednu dávku, tedy bezmála 200 000 dolarů za 14denní léčbu. Společnost uvedla, že nový lék by měl být k dispozici do konce roku 2022.
(red)
Literatura:

Reportáže a rozhovory z odborných kongresů
Opouštíte prostředí společnosti Pfizer, spol. s r. o.
Společnost Pfizer, spol. s r. o., neručí za obsah stránek, které hodláte navštívit.
Přejete si pokračovat?