
Reportáže a rozhovory z odborných kongresů
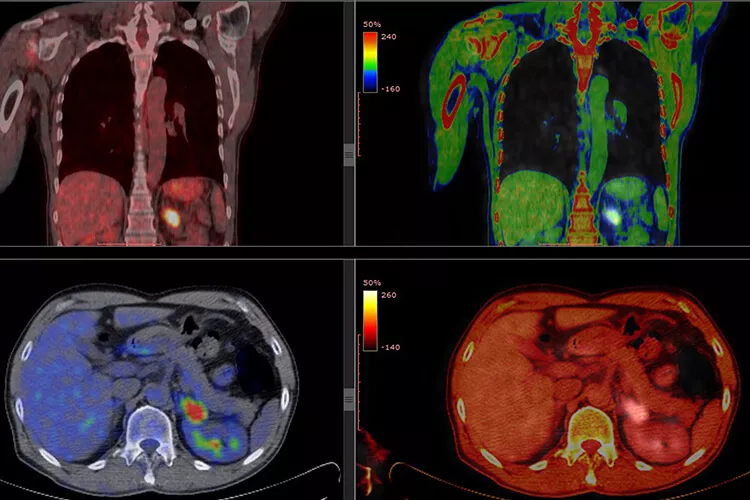
Zobrazovací metody k diagnostice mnohočetného myelomu (MM) neodmyslitelně patří již mnoho let. PET/CT je hybridní vyšetřovací metoda, která přináší informace nejen morfologické, ale i funkční. Přestože oproti magnetické rezonanci (MRI) přináší nevýhody především ve formě radiační zátěže, v posuzování rozsahu postižení skeletu má jednoznačně své místo. Co lze od PET/CT v diagnostice čekat a jak z výsledků vytěžit maximum?
Už v roce 2004 byly tomografické metody podle guidelines považovány za důležitou součást diagnostiky mnohočetného myelomu. Podle European Myeloma Network (EMN 2015) je u pacienta s podezřením na monoklonální gamapatii vždy potřeba provést celotělové nízkodávkové CT (ldCT), a pokud je negativní, mělo by následovat ještě dovyšetření pomocí MRI. PET/CT se podle těchto doporučení nejvíce hodí k potvrzení diagnózy a hodnocení léčebné odpovědi. Podle European Society for Medical Oncology (ESMO 2017) lze získat nejvíce informací pomocí kombinace zmíněných přístupů. Celotělové ldCT nejlépe odhalí lytické léze; MRI rozpozná postižení míchy a pánve. Pomocí PET/CT se diagnostikují kostní léze a plazmocytom.
Často citována bývají také kritéria International Myeloma Working Group (IMWG 2014), v nichž se uvádí, že PET/CT, celotělové ldCT nebo MRI jsou vyšetření zvláště vhodná pro diagnostiku vysoce rizikového, asymptomatického mnohočetného myelomu (SMM). V případě, že je na CT odhaleno jedno nebo více osteolytických ložisek větších než 5 mm, dochází již k naplnění kritérií kostní nemoci. Metabolická aktivita na PET/CT musí být potvrzena přítomností osteolytických ložisek, v některých doporučeních se však PET pozitivita bere jako samostatný parametr.
Důležitost PET/CT spočívá především v tom, že přináší kombinace informací morfologických a funkčních. Skládá se v podstatě ze dvou dílčích vyšetření – pozitronové emisní tomografie (PET) a výpočetní tomografie (CT). Informace funkční zprostředkovává PET; CT slouží k rekonstrukci obrazu a korekci zeslabení ve tkáních. Provedení pouhého PET bez CT není možné, přístroje se totiž vyrábějí tak, že vždy dochází k této kombinaci metod. Obraz PET navíc bez korekce pomocí CT bývá neostrý a pro většinu lékařů špatně čitelný.
PET/CT vyšetření by nebylo možné provádět bez radiofarmak. Jejich výroba a používání jsou přísně kontrolovány nejen Státním ústavem pro kontrolu léčiv (SÚKL), ale i Státním úřadem pro jadernou bezpečnost (SÚJB). Ačkoliv je jistě důležité dbát na bezpečnost, složitý systém kontrol téměř znemožňuje zavádění nových radiofarmak do praxe. I když se totiž podaří splnit všechny požadavky SÚKL a SÚJB, stále je třeba, aby specifické radiofarmakum vůbec někdo vyrobil – a to ideálně v ČR, protože tyto přípravky ze své podstaty podléhají jadernému rozpadu a není vhodné je přepravovat na velké vzdálenosti. Proto i když se v řadě článků mluví o různých nových metodách, v praxi jsou stále spíše ojedinělé.
Jedním z často používaných radiofarmak je 18F-FDG, přípravek, který umožňuje sledovat stupeň vychytávání a počáteční fáze metabolismu glukózy (GLC) ve tkáních. Využití této metody je běžné, avšak zrovna v případě mnohočetného myelomu poněkud ošemetné. Klasická GLC vstupuje do buňky specifickým transportérem a vzápětí je zpracována procesem glykolýzy, který je zahájen fosforylací GLC. GLC ve formě 18F-FDG prochází obdobným procesem, ale po fosforylaci hexokinázou nemůže pokračovat do glykolýzy, takže se v buňce hromadí a díky své radioaktivitě „rozsvítí“ celou lézi. Pokud však nefunguje transportér nebo enzym fosforylující GLC, nefunguje ani diagnostika – a klíčové komponenty metabolismu 18F-FDG mohou být ovlivněny jak typem mnohočetného myelomu, tak jeho léčbou.
Důležité je také znát pojem SUV (standardized uptake value), který vyjadřuje jakousi kvantifikaci výsledků PET/CT, ve zkratce, „jak moc ložisko svítí“. Jak si to představit? Pomocí jednoduchého myšlenkového modelu, v němž je pacient nahrazen nádobou s vodou, do níž se aplikuje radioaktivní látka. Když se změří radioaktivita v jednom mililitru tekutiny, výsledek představuje SUV 1. Reálné výsledky, například SUV 3, ukazují násobek homogenní distribuce radiofarmaka v těle, tedy individuální míru „svítivosti“, a jsou ovlivněny složením tkání pacienta. U jedince s vyšším množstvím tukové tkáně rozhodně nedojde k homogennímu rozložení 18F-FDG a je třeba počítat s tím, že SUV vyjde jinak, než je obvyklé.
U PET/CT se občas v případě malých lézí lze setkat s popisem „pod rozlišením PET“. Co tento nepřesný pojem znamená? Existuje-li více ložisek o stejných patologických vlastnostech, ale různém objemu, bude více viditelné větší ložisko, i když je radiofarmakum v obou lézích naprosto totožné. Je to dáno tím, že kamera má pouze určitou schopnost detekce, a právě ta u malých lézí selhává; bývají tak často podhodnoceny. U lézí o velikosti kolem 5 mm a menších je tak PET/CT jen velmi obtížně využitelné.
Záleží však také na aviditě léze – tedy nakolik je schopná radiofarmakum akumulovat. Například u pacientů s melanomem bývají i drobné, 3mm léze vysoce aktivní a na PET/CT dobře rozpoznatelné. Naproti tomu u mnohočetného myelomu dochází k mnohem menší akumulaci GLC buňkami a metoda využití 18F-FDG tak má své limitace.
Je vhodné si uvědomit, jaká je vlastně fyziologická distribuce GLC v těle. Hodinu po intravenózní aplikaci 18F-FDG se nejvíce této látky vyskytuje v moči, konkrétně 20–40 %. Přibližně 7 % 18F-FDG bude po této době v mozku, 4,5 % v játrech a 3,3 % v srdci. Na kostní dřeň, která při vyšetření mnohočetného myelomu bude lékaře zajímat nejvíce, vychází pouze 1,7 % 18F-FDG. Ještě o něco méně GLC bude v ledvinách (1,1 %) a v plicích (0,9 %). PET/CT se provádí asi hodinu po aplikaci radiofarmaka, takže uvedená distribuce odpovídá tomu, co lze na jeho výsledcích vidět. V kostní dřeni tedy fyziologicky dochází k jistému hromadění GLC, jehož míra závisí na metabolické aktivitě kostní dřeně. Ta může být buď difúzní, nebo – jako u mnohočetného myelomu – v rámci infiltrace.
U pacientů s hematologickou malignitou je třeba myslet na možnost léčby stimulačními faktory, a pokud tato terapie probíhá, pak na to před vyšetřením upozornit. Při použití stimulačních faktorů dochází k prudkému zvýšení metabolismu kostní dřeně, což může lékaře při posuzování výsledků značně zmást, protože není jasné, zda jde o masivní infiltraci, nebo naopak důsledek léčby. Problémy při hodnocení způsobuje také hnědý tuk, který se nachází v oblasti krku a může být zaměněn za infiltrované lymfatické uzliny. Proto je třeba v přípravě na vyšetření dbát na tepelný komfort a maximální omezení stresu pacienta (včetně uklidňujících prostředků u výrazněji nervózních nemocných), aby byla hnědá tuková tkáň co nejméně aktivní. Při nejasnostech je nutné výsledky PET/CT porovnat s klasickým CT – to totiž pomůže rozhodnout, zda se lékař dívá na aktivizovanou tukovou tkáň, nebo na uzlinu.
Na co je potřeba myslet při přípravě pacienta na vyšetření? Cílem přípravy při aplikaci 18F-FDG je udržet co nejnižší inzulinemii – aby se použitá GLC nestahovala do svalů a tuku. Proto musí nemocný šest hodin lačnit a pít pouze vodu; diabetici před vyšetřením vynechají dávku inzulinu. Je totiž třeba, aby 18F-FDG vstupovala hlavně do maligní tkáně, proto je snaha omezit její příjem tkáněmi, v nichž je vstup GLC regulován inzulinem.
A jak je to s glykemií? V požadavcích studií by neměla glykemie před vyšetřením přesáhnout 11 mmol/l, neexistuje však důvod, proč by při vyšší hladině GLC v krvi neměla PET/CT fungovat. Pokud jde na PET/CT pacient, který není zařazen v žádné studii, a jeho glykemie mírně přesáhne uvedenou hodnotu, stačí tento poznatek zaznamenat stranou a vyšetření je stále možné provést.
V případě, že se vyšetření 18F-FDG provádí u nemocného s MGUS nebo low-risk SMM, bude jeho výsledek zpravidla negativní; mírná heterogenita kostní dřeně není na PET/CT vidět. U SMM by mělo být dále provedeno vyšetření MRI, na němž mohou být patrné drobné léze na páteři a v oblasti pánve. Obecně platí, že použití zobrazovacích metod vede k jakémusi „upstagingu“ – pokud se na vyšetření něco odhalí, pacient se posouvá do rizikovější skupiny a je k němu přistupováno jiným způsobem.
Síla PET/CT při stagingu spočívá především v hodnocení fokálních lézí nebo jasné difúzní metabolické aktivity. Velkou výhodu přináší možnost celotělového zobrazení. Problém vyvstává u non-FDG avidních mnohočetných myelomů; v tomto případě je snížena exprese hexokinázy a použití 18F-FDG tak selhává. Pomocí MRI se naproti tomu lépe hodnotí difúzní postižení a poškození v oblasti pánve a také menší ložiska kolem 5 mm. Důležité je říci, že PET/CT a MRI se skutečně v diagnostice doplňují, protože každé z těchto vyšetření vidí jiná ložiska – PET/CT „uvidí“ navíc cca 30 % lézí, ke kterým je MRI „slepá“, a stejně to platí i naopak. Ideální je proto tato vyšetření kombinovat.
PET/CT je schopna poměrně senzitivně odhalit i extramedulární postižení, což je nezávislý negativní prognostický faktor mnohočetného myelomu; nelze však zapomínat na to, že léze v extramedulární oblasti ještě nemusejí nutně znamenat právě mnohočetný myelom. Hypermetabolismus GLC totiž, kromě nádoru, provází například i zánětlivé léze; v případě difúzního postižení nebo jiných nejasností je opět vhodné PET/CT kombinovat s MRI.
Nejednoznačné nálezy představují především fraktury. Prostá zlomenina ve sklerotickém terénu pravděpodobně představuje projev mnohočetného myelomu, ale rozlišení od traumatického postižení, fraktury při osteoporóze, únavové zlomeniny (stress fracture) či kostního infarktu může být složité. GLC se akumuluje úplně stejně v ložisku mnohočetného myelomu a v kosti hojící se po zlomenině.
Výhodou celotělového PET/CT je komplexnost výsledků, které je schopné poskytnout. Přináší možnost vyšetření celého těla a odhalení extramedulárních ložisek mnohočetného myelomu. Vyznačuje se vysokou senzitivitou a poměrně solidní specifitou, ale pro lepší zhodnocení lézí je vhodné jej kombinovat s MRI. U mnohočetného myelomu lze občas narazit na limitace PET/CT kvůli použití 18F-FDG v kombinaci s non-avidními lézemi, v nichž je přítomna porucha hexokinázy. Je otázkou, zda by šlo situace, v nichž PET/CT zaostává, vyřešit používáním jiných typů vyšetření s jinými radiofarmaky, například 99mTc-MIBI, které se taktéž akumuluje v metabolicky aktivních tkáních, ale vykazuje vazbu na mitochondrie a oproti PET je citlivější na difúzní postižení kostní dřeně.
Redakčně zpracováno ze sdělení, které na XVIII. národním workshopu mnohočetný myelom v Mikulově přednesl:
MUDr. Martin Havel, Ph.D.
Klinika nukleární medicíny LF OU a FN Ostrava
Reklamní sdělení

Reportáže a rozhovory z odborných kongresů
Opouštíte prostředí společnosti Pfizer, spol. s r. o.
Společnost Pfizer, spol. s r. o., neručí za obsah stránek, které hodláte navštívit.
Přejete si pokračovat?